1.4. Розподіл електронів у атомах по оболонках та всередині оболонок
Оболонки в атомах прийнято позначати буквами латинського алфавіту. При цьому найближча до ядра електронна оболонка (п = 1) позначається буквою К, наступна (п=2) - буквою L і так далі (М, N,...). Повне число електронів в К-оболонці (2п2) не може бути більшим двох, в L-оболонці - не більшим восьми, а в М-оболонці - не більшим 18.
Енергетичні рівні в підоболонках, які характеризуються різними значеннями орбітального квантового числа 1 (0, 1, 2,..., п - 1), прийнято позначати буквами s, p, d, f, b в такій самій послідовності. Ці позначення відповідають старим назвам спектральних серій. Головне квантове число в позначенні енергетичних рівнів ставиться перед цими буквами. Наприклад, позначення 4d означає, що мова йде про енергетичний рівень в атомі з головним квантовим числом п=4 (N-оболонка) та з орбітальним квантовим числом 1 = 2.
Найпростішим в атомі є S-стан (1 = 0). В ньому може знаходитися не більше двох електронів, тому що при 1 = 0 можливе лише одне значення квантового числа тl(тl= 0). Стани p, d, f і так далі розщеплюються на підрівні, бо кожному з них відповідає ряд значень квантового числа тl. Числа можливих електронних станів у різних оболонках атомів наведені в табл.1.2, а в різних підоболонках - в табл. 1.3.
Розподіл електронів по оболонках та всередині оболонок незбуджених атомів зручно показати за допомогою схеми, наведеної в табл.1.4.
В міру зростання номера хімічного елемента в таблиці Д. І. Менделєєва число протонів у ядрі зростає. Відповідно зростає і число електронів у атомі, і вони послідовно заповнюють одну оболонку за другою. Коли, наприклад, в атомі міститься не більше 10 електронів, то для їхнього розміщення достатньо двох оболонок. У найближчій до ядра К-оболонці може розміститися тільки два електрони. Тому інші електрони мають розташуватися у шарах з більш високими допустимими енергіями. При наявності в атомі 10 електронів вони знаходяться також в К- і A-оболонці, яка вміщує вісім електронів. Коли ж число електронів в атомі більше 10, то електрони будуть заповнювати також і М-оболонку, яка вміщує 18 електронів. Після заповнення М-оболонки заповнюється У-оболонка і так далі.
Таблиця 1.2
Числа можливих електронних станів в оболонках, які відповідають різним значенням головного квантового числа
Головне квантове число n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Символ оболонки | K | L | M | У | O | P | Q |
Максимальне число можливих електронних станів | 2 | 8 | 18 | 32 | 50 | 72 | 98 |
Таблиця 1.3
Числа можливих електронних станів в підоболонках, які відповідають різним значенням орбітального квантового числа
Значення орбітального квантового числа l | 0 | 1 | 2 | 3 | 4 |
Символ підоболонки | s | p | d | f | b |
Число можливих електронних станів | 2 | 6 | 10 | 14 | 18 |
Як ілюстрація викладеного, графічно на рис. 1.7 без витримки масштабу зображені схеми заселення електронами енергетичних рівнів в атомах натрію (заряд ядра Z=11) і аргону (заряд ядра Z= 18). Електрони на рис. 1.7 умовно зображені кружками, а стрілки вказують на можливі електронні переходи, що призводять до збудження цих атомів та емісії фотонів, яка за ним виникає.
Таблиця 1.4
Схема максимального заповнення енергетичних рівнів атомів
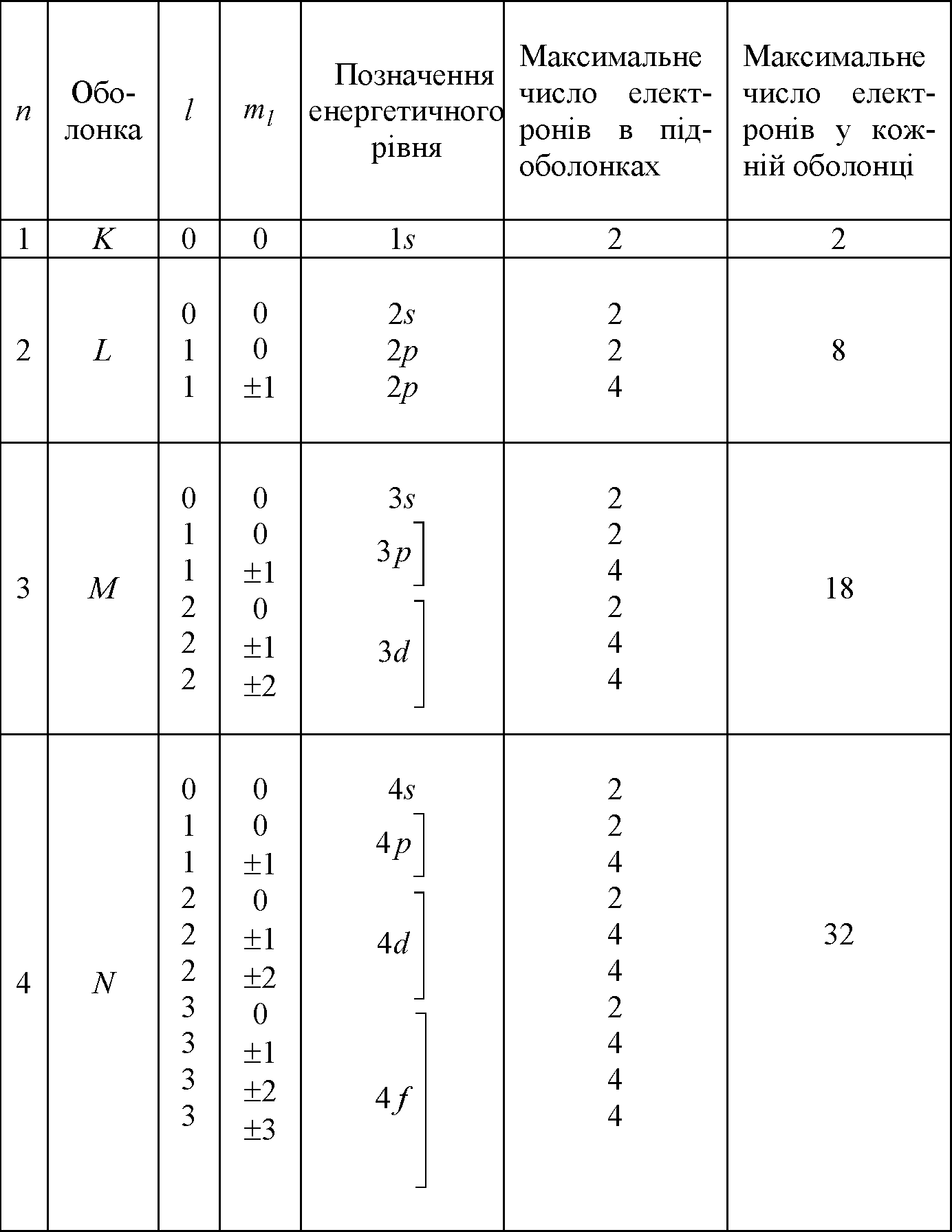
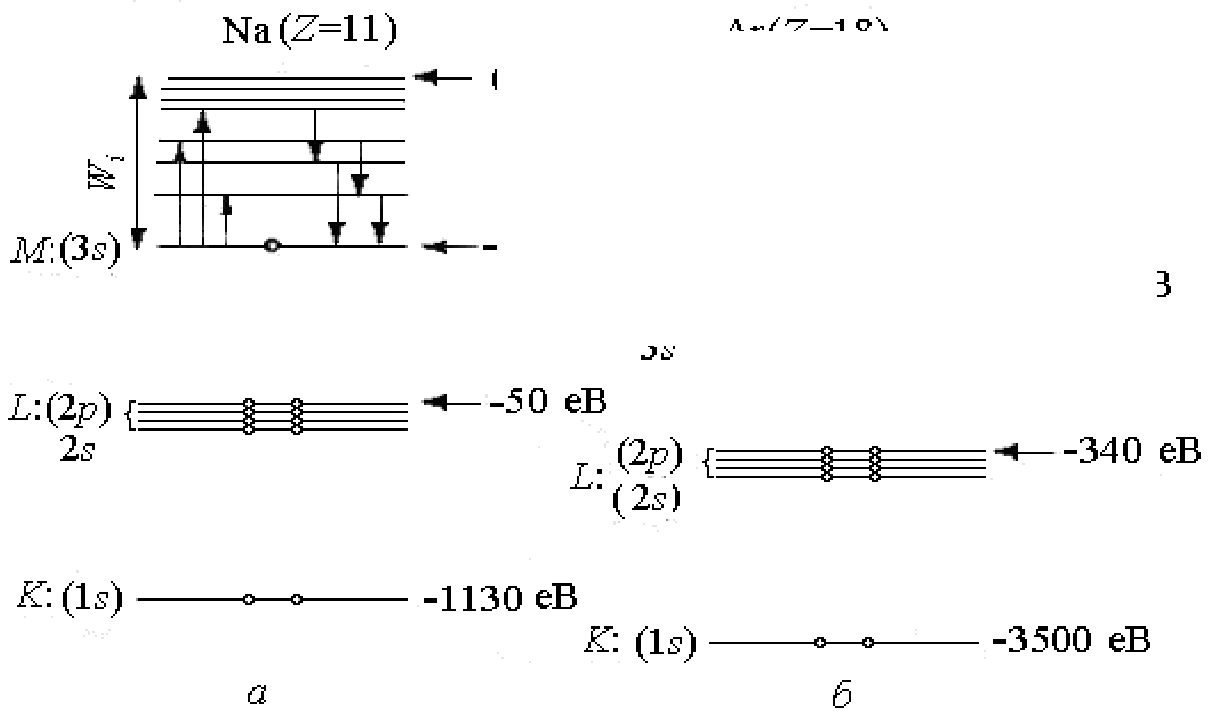
Рис. 1.7. Схеми заселеності електронами енергетичних рівнів в атомах натрію (а) та аргону (б)
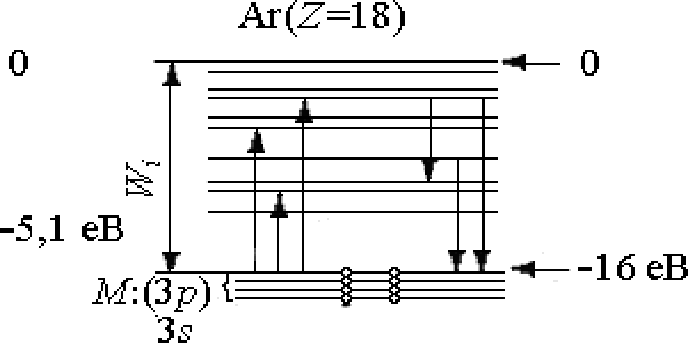
Такий порядок, коли спочатку заповнюється оболонка з меншим значенням головного квантового числа п, а потім починається заповнення електронами наступної оболонки, завжди має місце у випадку легких атомів. При цьому в межах однієї оболонки спочатку заповнюється стан, який відповідає значенню квантового числа тl=0, а потім - стани з більшими значеннями цього числа (до т1=n -1). Проте для калію, який містить 19 електронів, та деяких інших більш важких елементів взаємна відштовхуюча дія електронів стає такою, що для певних дозволених для електронів орбіт з більшим значенням головного квантового числа відповідає менша енергія, ніж для ще не зайнятих орбіт з меншим значенням цього квантового числа. Відбувається ніби перекриття суміжних енергетичних рівнів. Це відноситься до рівнів (п+1)s, (п+1)р таких елементів і відповідно до рівнів nd та nf. Зони заборонених рівнів енергії електронів у атомах, які відокремлюють одну від одної зони дозволених рівнів (див. рис. 1.7), при віддаленні від ядра все більше звужуються і при досить значному віддаленні від ядра розподіл дозволених для електронів енергетичних рівнів енергії фактично стає неперервним.